¿Por qué las Bebidas sin Alcohol afectan al Tejido Adamantino?
Las bebidas sin alcohol son consumidas por individuos de todas las edades y constituyen hábitos alimenticios que pueden conducir al deterioro del esmalte dental. Los factores relacionados con ello son variados pero fundamentalmente tienen relación con la composición de la bebida.
Autores:, Abal A., Belloni F., Merlo D., Ingeniero M., Viskovic C., Lazo G., Barceló A., Barrasa E., Delandaburu R., Gómez Bravo F., Guzmán M., Lazo Ivanov B., , Motta M., Ogas C., Procopio Rodríguez M., Felipe P., Papasodaro J., Pérez P., Pérez D., Saldías A., Tanevitch A. (Facultad de Odontología – UNLP)
INTRODUCCIÓN
El esmalte dental es un tejido mineralizado conformado por un denso empaquetamiento de cristales de hidroxiapatita, que le confieren la dureza superficial para soportar el impacto de las fuerzas masticatorias y de la oclusión entre piezas antagonistas.
Sin embargo, los cristalitos están inmersos en el medio líquido de la cavidad bucal por lo que sufren fenómenos de disolución perdiendo iones calcio y fosfatos. Cuando la saliva se encuentra saturada de estos elementos, se produce un equilibrio entre los iones provenientes de los cristalitos y los de la saliva y el esmalte conserva su integridad.
Existen dos fenómenos que conducen a la desmineralización del esmalte dental. Las caries son el resultado de procesos de desmineralización crónicos, prolongados, por la acción de ácidos orgánicos producidos por bacterias acidógenas de la placa dental, durante la fermentación de carbohidratos provenientes de la dieta. En cambio, la erosión dental es el resultado de una pérdida crónica localizada de tejido dental duro, por los ácidos derivados de la dieta o de reflujo gástrico que producen el ataque químico de la superficie.
En la erosión, se determinó que el grado de desmineralización del esmalte dañado, en comparación con el contenido mineral original, era del 62% para el calcio y el 64% para el fósforo inorgánico [1]. Cuando la pérdida mineral alcanza valores del 30 al 50% se produce el desmoronamiento y la cavitación [2]. Estas lesiones del tejido adamantino se producen aun sin presencia de azúcares y sin actividad bacteriana.
Las bebidas sin alcohol son consumidas por individuos de todas las edades y constituyen hábitos alimenticios que pueden conducir al deterioro del esmalte dental. Los factores relacionados con ello son variados pero fundamentalmente tienen relación con la composición de la bebida.
METODOLOGÍA
Se estudiaron distintas marcas comerciales de bebidas sin alcohol: bebidas sabor cítrico (jugos preparado y para preparar, aguassaborizadas) y bebidas regulares gaseosas sabor cola y naranja.
Se determinó el pH con pHmetroSilverCapTM en escala 0-14 con 2 décimas de precisión perteneciente al Laboratorio de Investigaciones en Física Metalúrgica (LIMF-UNLP). Se utilizaron 50 ml de bebida recién destapada, a temperatura ambiente. Se colocó el pHmetro y se dejó estabilizar 2 minutos. Luego se registró el valor obtenido.
RESULTADOS
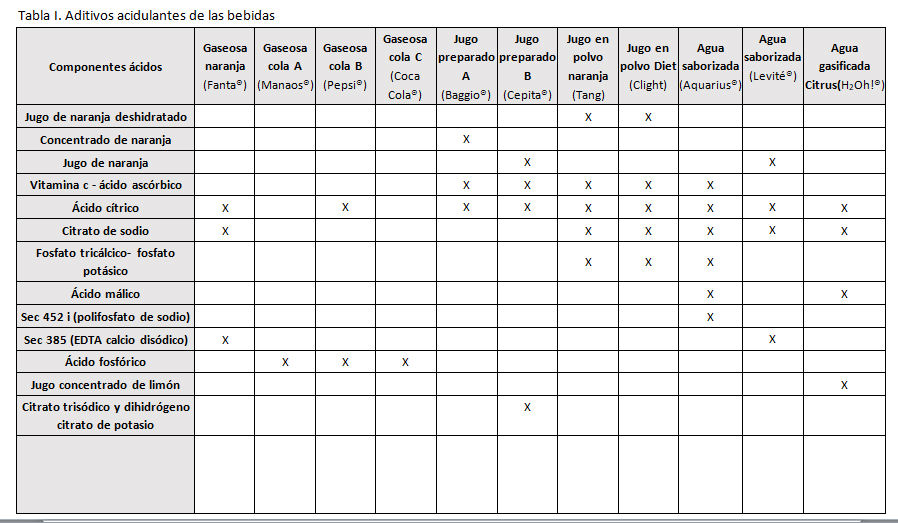
Se demostró que las bebidas gaseosas de sabor cola fueron las que presentaron el valor de pH más bajo. (3,29 y 2,93). En los jugos de preparados el pH también fue bajo (3,52 y 3,74) pero resultó mayor que en las gaseosas. El agua saborizada presentó un valor de 3,68. En la composición de las bebidas se encontraron aditivos acidulantes (Tabla 1), azúcares (JAF), carboximetilcelulosa (actúa como espesante y formador de películas), conservantes (CONS), vitaminas, colorantes (COL), secuestrantes (SEC), cafeína, cloruro de sodio, esencia (cola), gomas, sacarina, ciclamato, tartrazina. Los aditivos acidulantes se detallan en la Tabla I.
 |
CONCLUSIONES
Todas las bebidas presentaron pH menor a 4 coincidiendo con reportes de otros autores [3, 4, 5]. Matos Goncalveset al.[4] analizaron distintas bebidas a base de jugo de uva reportando valores de pH entre 2,9 y 3,5. Ehlenet al. [6] sostienen que el pH está determinado por la concentración y la intensidad del ácido en la solución.
Según la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica(ANMAT), los aditivos son ingredientes agregados intencionalmente con el propósito de modificar las características físicas, químicas, biológicas o sensoriales de un alimento. Éstos pueden ser antioxidantes, espesantes, colorantes, conservantes, etc.endulzante que pueden producir alteraciones en la salud sisu consumo es excesivo [7].
Entre los aditivos con poder acidulante encontramos el ácido cítrico y el ácido fosfórico.El ácido cítrico es un ácido orgánico débil tricarboxílico que está presente en la mayoría de las frutas, sobre todo en cítricos. Su fórmula molecular es C6H8O7.
La acidez del ácido cítrico es debida a los tres grupos carboxilos -COOH que pueden perder los protones, formando derivados como el citrato. Los citratos son unos buenos controladores del pH de soluciones ácidas. Los iones citrato forman sales con muchos iones metálicos. El ácido cítrico puede quelar metales.
La quelación es el proceso de unión entre una o más moléculas de ácido cítrico y los iones del metal, separándolos de una forma compleja y dejándolos inactivos [8]. En cambio, el ácido ortofosfórico (H3PO4) es un acidulante sintético que se suele utilizar en sustitución del ácido cítrico.
Algunas bebidas contienen además de ácido cítrico, EDTA o ácido etilen-diamino-tetra-acético que también tiene acción quelante y forma compuestos estables con el calcio.
El contenido de acidulantes en las bebidas sin alcohol origina un valor de pH muy por debajo del pH crítico de la hidroxiapatita que es 5,5. Al descender el pH del medio líquido que rodea al cristal del esmalte dental, se libera calcio produciendo desmineralización [9]. La combinación de ácido cítrico con EDTA, produce un efecto quelante sobre el calcio, que pierde disponibilidad para reponerse en el fenómeno de re mineralización [10].
Concluimos que los acidulantes presentes en las bebidas sin alcohol como jugos, aguas saborizadas o gaseosas sabor cola le confieren un bajo pH. El esmalte expuesto a estas bebidas en forma frecuente, puede sufrir lesiones de erosión por desmineralización con el consecuente daño tisular y la imposibilidad de reparación natural mediante la acción de la saliva.
REFERENCIAS
- Einserburger M, Hughes J, West NX, Shellis RP Addy M. The use of ultrasonication to study remineralizatin of eroded enamel. Caries Res. 2001; (35): 61-66.
- Jager DHJ, Vieira AM, Ruben JL, Huysmans. Estimated erosive potential depends on exposure time. Journal of Dentistry 2012, 40:p. 1103–1108. Disponible en: www.sciencedirect.com
- Yin-Lin Wang, Chia-Chieh Chang, Chih-Wen Chi, Hao-Hueng Chang, Yu-Chih Chiang, Yueh-Chiao Chuang, Hsiao-Hua Chang, Guay-Fen Huang , Yunn-Shiuan Liao, Chun-Pin Lin. (2014) Erosive potential of soft drinks on human enamel: An in vitro study. Journal of Formosan Medical Association 113: 850-856.
- Matos Gonçalves GK, BrandaoGuglielmiCde A, PiresCorrêa FN, Raggio DP, PiresCorrêa MS. Erosive potential of different types of grape fruit juicesl. Braz. Oral Res. Sep-Oct 2012; 26(5): 457-463.
- Mesquita-Guimarães KSF de, Scatena C, Borsatto MC, Rodrigues-Júnior AL, Serra MC. Effect of foods and drinks on primary tooth enamel after erosive challenge with hydrochloric acid. Braz. Oral Res. (On line). 2015 29(1): 1-7.
- Ehlen Leslie A, Marshall Teresa A, Qian Fang , Wefel James S, Warren John J. Acidic beverages increase the risk of in vitro tooth erosion. Nutr Res.2008; 28(5): 299-303.
- ANMAT. Aditivos en los alimentos. [On line] Consultado 17-03-2021 de:
http://www.anmat.gov.ar/consumidores/alimentos/aditivos.pdf - Moreno Ruiz X, Narváez Carrasco CG, y Bittner Schmid V. In Vitro Effect of Refreshing Drinks on the Mineralization of Tooth Enamel Surface in Extracted Permanent Dental Pieces. Int. J. Odontostomat.2011; 5(2): 157-163.
- Núñez DP, García Bacall L. Biochemistry of dental caries. Rev HabanCiencMéd. (On line). Abr. -jun. 2010; 9(2). Disponible en:
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1729-519X2010000200004 - Buttani N, Riveros E, Dolonguevich E. Cambios morfológicos en la estructura del esmalte dental debido al consumo de bebidas industrializadas FAC. DE ODONTOLOGÍA. UNCuyo. 2015. 9(1): 21-23

